Las proteínas se pueden separar y purificar en función de su tamaño, de su carga, ... para su estudio.
En el laboratorio las fuentes principales de donde se obtienen las proteínas para su estudio son dos:
- Células tisulares
- Células microbianas
El primer paso es romper lás células, liberando las proteínas en un extracto crudo. En ocasiones también es necesario realizar una centrifugación diferencial, por ejemplo para aislar determinados orgánulos celulares.
El siguiente paso ya sería someter al extracto crudo a diferentes tratamientos que separen las proteínas en diferentes fracciones (por tamaño o cargo), lo que se se conoce como fraccionamiento.
Uno de estos tratamientos sería el salting out, que se basa en las diferencias de solubilidad de algunas proteínas en presencia de una sal (como por ejemplo, el sulfato amónico), En este proceso algunas proteínas precipitan mientras otras quedan en disolución. Posteriormente las proteínas precipitadas se separan por centrifugación a baja velocidad.
Otro tratamiento sería la diálisis, que consiste en separar las proteínas de otras moléculas de pequeño tamaño, utilizando una membrana semipermeable. Por ejemplo se puede utilizar para eliminar el sulfato amónico utilizado en el salting out.
En la cromatografía de columna se utiliza un material poroso (que se denomina fase estacionaria), que se introduce en una columna. Se hace pasar a través de ella una disolución tamponada (que será la fase movil). Las proteínas se encuentran en esta fase movil, se depositarán en la parte superior de la columna, y según su tamaño irán migrando a diferente ritmo a través de la columna).
La cromatografía iónica utiliza las cargas iónicas de las proteínas (la cromatografía de columna utiliza el tamaño). La matriz (fase estacionaria) es una resina que incorpora grupos con carga eléctrica.
Otros tipos de cromatografías serían la cromatografía de exclusión molecular o la cromatografía de afinidad.
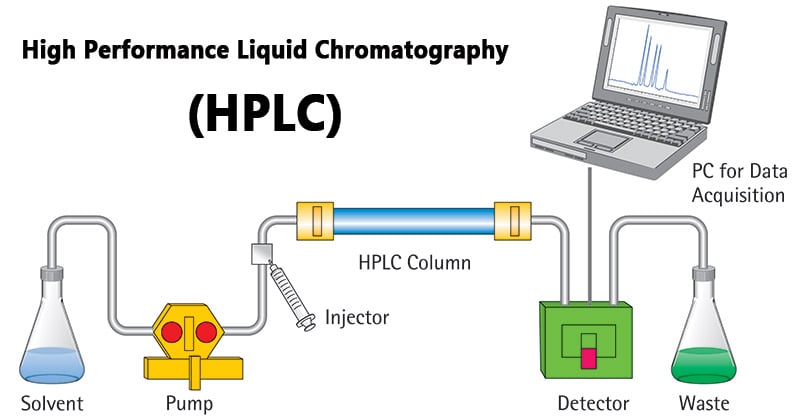
Un último tipo de cromatografía sería la HPLC, o cromatografía líquida de alta definición. Esta técnica utiliza bombas de alta presión para aumentar el movimiento de las proteínas a través de la columna, mejorando así su resolución.
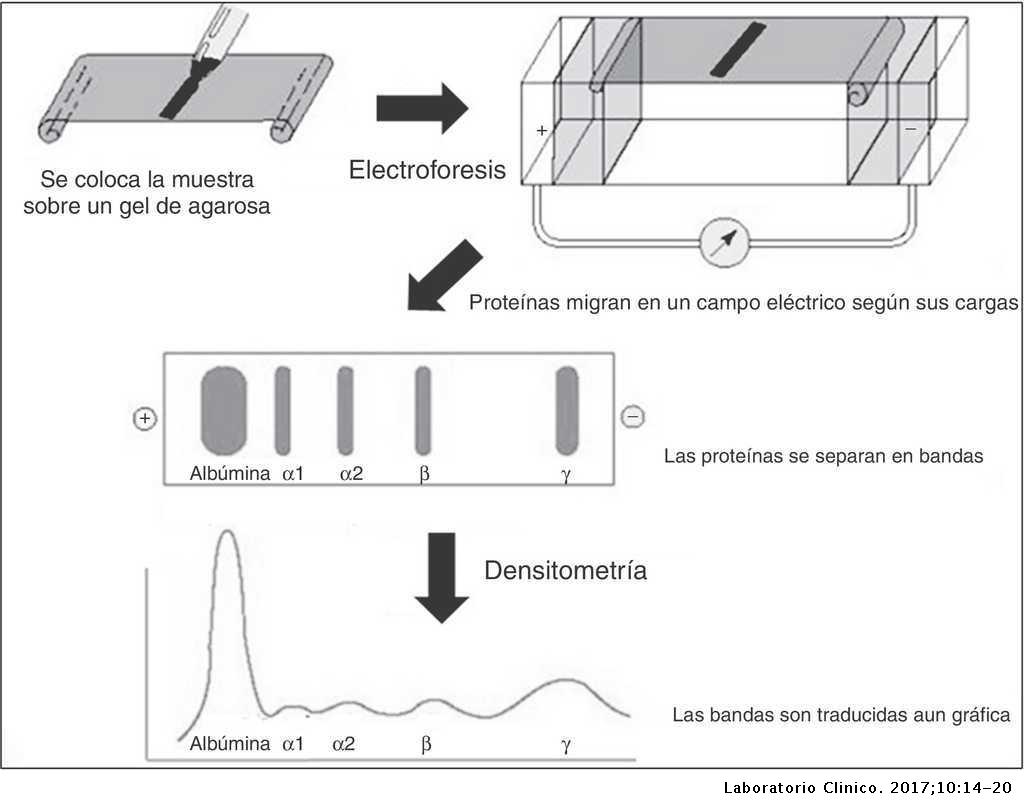
La electroforesis es una técnica que separa las proteínas utilizando el desplazamiento de las proteínas cargadas en un campo eléctrico.
Se usan geles de poliacrilamidas como soporte.
Para que todas las proteínas tengan la misma carga y una forma similar (así las proteínas se separaran en función de su masa molecular) se utiliza SDS.
Además se añade un colorante, el azul Croomassie, que se fija a las proteínas pero no al gel (que nos permitirá obserbar las bandas).
Una vez que tenemos las bandas a diferentes alturas del gel se comparan con marcadores de masas moleculares conocidas.
El enfoque isoeléctrico permite determinar el punto isoeléctrico de una proteína. Mientras que el enfoque bidimensional (combinar el enfoque isoeléctrico y una electroforesis en SDS) permite separar proteínas de idéntica masa molecular pero diferente punto isoeléctrico, o separar proteínas con punto isoeléctrico similar pero diferente masa molecular.
Por último otro estudio de las proteínas es medir la actividad enzimática (la mayor parte de los enzimas son proteínas).


No hay comentarios:
Publicar un comentario