Aminoácidos
Las proteínas son las macromoléculas más abundantes que se encuentran en las células. Hay miles de proteínas diferentes, que cumplen gran variedad de funciones, como por ejemplo:
- Enzimas
- Hormonas
- Anticuerpos,...
Las proteínas están formadas por subunidades básicas: los aminoácidos.
Aunque en la naturaleza se pueden encontrar gran cantidad de aminoácidos diferentes, en las proteínas solo se encuentran 20 tipos de aminoácidos diferentes.
Su estructura es sencilla. Tienen un carbono alfa unido a un grupo amino (NH₂), un grupo carboxilo (COOH), un protón y una cadena lateral R (esta será la que diferencie a los distintos tipos de aminoácidos, y que determinará su solubilidad en agua, su carga, ...).
El carbono alfa es un carbono quiral, es decir, está unido a cuatro grupos diferentes (excepto en la glicina, que su cadena lateral el un protón). Debido a esto cada aminoácido presenta dos esteroisómeros (imágenes especulares, superpuestas entre sí, como las manos), la forma D y la forma L.
En las proteínas solo encontramos las formas L.
El primer aminoácido descubierto fue la asparagina, en el año 1806.Muchos de ellos recibieron el nombre de la fuente en la que fueron identificados por primera vez, como el glutamato que se aisló del gluten del trigo.
Tienen un nombre en común, y un código de tres letras como abreviatura (junto con un símbolo de una letra).
A pH=7 (como el que tenemos en la sangre), los aminoácidos se encuentran ionizados, es decir, el grupo amino se encuentra como NH₃⁺ (con una carga positiva) y el grupo carboxilo como COO⁻ (con una carga negativa), dando como resultado una carga neta igual a 0. Por lo tanto la carga eléctrica del aminoácido dependerá de su cadena lateral R.
Así que los aminoácidos se clasificarán según sea su cadena lateral:
- Apolares
- Aromáticos
- Polar sin carga
- Con carga negativa
- Con carga positiva
Aminoácidos apolares
Reciben también el nombre de alifáticos. No tienen carga eléctrica, son hidrofóbicos (no interactúan con el agua).
Son:
- glicina
- alanina
- prolina
- valina
- leucina
- isoleucina
- metionina
La metionina es uno de los dos aminoácidos que contienen un átomo de azufre en su estructura (junto con la cisteína).
La prolina tienen una cadena cíclica (y un grupo imino, en vez de amino) que reduce la flexibilidad de las proteínas que contienen este aminoácido.
Aminoácidos aromáticos
Relativamente apolares.
Son:
- fenilalanina
- tirosina
- triptófano
Aminoácidos polares sin carga
Son capaces de establecer puentes de hidrógeno con moléculas de agua (con sus grupos OH).
Son:
- serina
- ciesteína
- treonina
- asparagina
- glutamina
Aminoácidos con carga positiva (básicos)
Están cargados positivamente a pH 7.
Son:
- lisina
- arginina
- histidina
Aminoácidos con carga negativa (ácidos)
Están cargados negativamente a pH 7.
Son:
- aspartato
- glutamato
Los aminoácidos podrán ser sintetizados por el metabolismo de las células o ser ingeridos en la dieta (como por ejemplo los denominados aminoácidos esenciales, que no somos capaces de sintetizar y necesitamos ingerirlos obligatoriamente por la dieta) .
En las células además podemos encontrar aminoácidos modificados, como la 4 - hidroxiprolina, la desmosina, la selenocisteina o la citrulina, que cumplen importantes funciones.
Los aminoácidos recordemos que a pH 7 se encuentran en forma de ión dipolar (o zwitterion), con los grupos amino y carboxilo ionizados, y pueden actuar como ácidos o bases débiles (captar o ceder protones). Debido a esta capacidad se les considera sustancias anfóteras.
Para conocer como se comporta un aminoácido según va cambiando el pH se realiza una titulación ácido - base, que consiste en poner al aminoácido en un pH ácido muy bajo, e ir añadiendo OH (para que aumente el pH de la disolución).
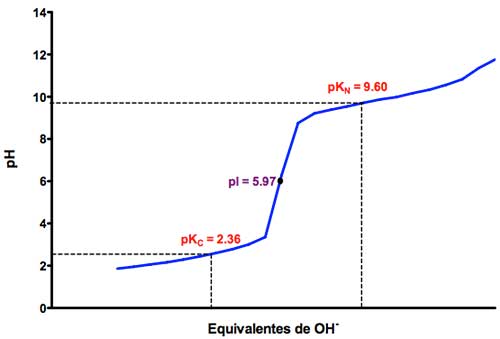
En el caso de la glicina, el aminoácido más simple, se obtiene la siguiente gráfica:
En la gráfica podemos observar dos valores de pK:
- pK ácido, en el cual el grupo carboxilo se encuentra como COO⁻ (ionizado) y el grupo amino como NH₂ (desionizado).
- pK básico, en el cual el grupo carboxilo se encuentra como COOH (desionizado), y el grupo amino como NH₃⁺ (ionizado).
- El punto isoléctrico (pI) es el punto en el que el aminoácido se encuentra en su forma de ión dipolar con carga neta igual a 0. Tanto el grupo carboxilo como el grupo amino están ionizados.
- Aparecen dos zonas de tamponamiento (el pH se mantiene estable aunque añadamos más OH), que coinciden con las zonas cercanas a ambos pK (en la gráfica la línea es horizontal).
Cada aminoácido tendrá sus propios valores de pK y punto isoeléctrico.
Los aminoácidos sin carga tendrán una gráfica similar a la de glicina, pero los aminoácidos que tengan una cadena lateral con carga presentarán una gráfica algo diferente, con 3 valores de pK (el tercer pK es el valor para la cadena lateral).
A pH 7 solo la histidina tiene una cadena lateral con un pK (zona de tamponamiento) cercano a 7, por lo tanto será el único aminoácido que le confiera poder tamponante a los proteínas en líquidos extra e intracelulares.
Enlace peptídico
Para formar las proteínas los aminoácidos deben unirse mediante un enlace que recibe el nombre de enlace peptídico.
Se forma entra el grupo carboxilo de un aminoácido y el grupo amino de otro aminoácido, liberándose una molécula de agua.
Si se unen unos pocos aminoácidos se formará un oligopéptido, mientras que si se unen muchos aminoácidos se formará un polipéptido.
Como los grupos carboxilo y amino de los aminoácidos participan en el enlace solo quedarán un grupo carboxilo y un grupo amino libres (los de los extremos), que reciben el nombre de resto C - terminal y resto N - terminal. Por lo tanto la carga de las proteínas dependerá de las cargas de las cadenas laterales.
El enlace peptídico solo tiene lugar debido a su alta energía de activación, lo que genera un enlace muy estable y que otorga a las proteínas una vida media muy elevada.
Existen proteínas que están formadas por una sola cadena peptídica, mientras que otras están formadas por varias cadenas peptídicas unidas de forma no covalente. En este segundo caso si al menos dos de estas cadenas son idénticas reciben el nombre de proteínas oligoméricas, y cada cadena es un protómero.
Sólo algunas proteínas tienen dos o más cadenas unidas de forma covalente, como por ejemplo la insulina.
Otro concepto es el de proteínas conjugadas, que son proteínas que están unidas a otro grupo químico 8que recibe el nombre de grupo prostético):
- lipoproteínas: unidas a lípiontravaledos.
- glucoproteínas: unidas a azúcares.
- metaloproteínas: unidas a un metal.




No hay comentarios:
Publicar un comentario